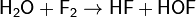Vilken substans är vatten?

Vatten är en oorganisk förening som består avfrån syre och väte. Under normala förhållanden är det en färglös, transparent vätska som inte har lukt och smak. I fast form kallas vatten snö, is eller frost och i gasform, ånga. Cirka 71% av planets yta är täckt med vatten. Ungefär 96% av vattenreserverna faller på oceanerna, medan resterande 4% är täckta av sjöar, glaciärer, träsk och grundvatten. Vatten är enligt sin natur ett utmärkt lösningsmedel och innehåller alltid lösliga ämnen eller gaser i dess sammansättning, med undantag av destillerat vatten. Vatten är den viktigaste livskällan på planeten. Därför kommer vi i denna artikel att försöka berätta allt om detta fantastiska ämne, och viktigast av allt, vilken typ av substansvatten är av naturen och vilka är dess kemiska och fysiska egenskaper.
Fysikaliska egenskaper hos vatten
- Under normala atmosfäriska förhållanden, vattenbehåller vätsketillståndet, samtidigt som de återstående väteföreningarna i en liknande plan är gaser. Detta fenomen beror på de speciella egenskaperna hos tillsatsen av molekyler och vattenatomer och de bindningar som finns mellan dem. Syreatomer är bundna till väteatomer, som bildar en vinkel på nästan 105 grader, och denna konfiguration är alltid bevarad. Genom ett stort elektronegativitet skillnad av syre- och väteatomer, elektronmoln skiftade starkt mot syre. Grund av denna anledning den vattenmolekyl anses aktiva dipol, varvid vätesidan har en positiv laddning, och negativ syre. Som ett resultat bildar vattenmolekylen bindningar, det är ganska svårt att bryta upp och det kommer att kräva mycket energi.
- Vattnet låter praktiskt taget inte att klämma. Så, med ökande atmosfärstryck med en stapel, komprimeras vatten endast av 0.00005 delar, från dess ursprungliga volym.
- Strukturen av is och vatten är mycket lika. Både i is och i vatten tenderar molekyler att bosätta sig i en viss ordning - de vill bilda en struktur, men termisk rörelse förhindrar det. När vattnet omvandlas till ett fast tillstånd hindrar molekylernas termiska rotation inte längre strukturformationen, varefter molekylerna beställs och hålrummen mellan dem ökar, vilket följaktligen minskar densiteten. Detta förklarar att vatten är en mycket onormal substans. Vätskans fasta aggregeringstillstånd är is, det kan säkert flyta på ytan av vätskans aggregatstillstånd. När förångning sker, tvärtom, är alla anslutningar omedelbart brutna. Brytningen av dessa bindningar kräver en stor mängd energi, vilket förklarar vattenens största värmekapacitet bland alla ämnen. För att värma en liter vatten med 1 grad måste du spendera cirka 4 kJ energi. På grund av den här egenskapen används ofta vatten som kylvätska.
- Vatten har en hög ytspänning,vilket ger endast kvicksilver i denna indikator. Viskens höga viskositet beror på dess vätebindningar, vilket förhindrar att molekyler gör rörelser vid olika hastigheter.
- Vatten är ett bra lösningsmedel. Molekylerna av lösningsmedlet omges omedelbart av vattenmolekyler. De positiva partiklarna av lösningsmedlet attraheras av syreatomer och negativa partiklar lockas av väteatomer. Eftersom vattenmolekylernas storlek är tillräckligt liten kan varje molekyl av en upplöst substans omedelbart omge ett stort antal vattenmolekyler.
- Vatten är ett ämne som har en negativ elektrisk potential för ytan.
- I sin rena form är vatten en god isolator,Men eftersom det ofta är dessa eller andra ämnen, salter eller syror upplöses, finns det alltid negativa och positiva joner i vattnet. På grund av dessa egenskaper kan vatten leda elektricitet.
- Brytningsindex för vatten är n = 1,33. Men vattnet absorberar infraröd strålning perfekt, och i samband med den här egenskapen är vatten, mer exakt vattenånga, en växthusgas. Vatten kan också absorbera mikrovågsstrålning, på vilken mikrovågsugnsverkan är baserad.
Kemiska egenskaper
De som tror att vatten är en organisk substans är starkt misstag. Vatten bildas av två element - syre och väte. Därefter beaktar vi de viktigaste kemiska egenskaperna hos vatten.
Du kan få vatten med följande reaktioner:
Också under neutraliseringsreaktionen:
Genom att reducera kopparoxid med väte:
Vid rumstemperatur reagerar vatten:
Med aktiva metaller:
Med fluor och halogenföreningar:
Med salter som bildas av en svag bas och en svag syra, samtidigt som de orsakar deras hydrolys:

- Med halogenanhydrider och anhydrider av oorganiska och karboxylsyror.
- Med organometalliska föreningar (Grignard-reagens, dietylzink, metylnatrium).
- Med nitrider, karbider, fosfider, hydrider, silikider av alkalimetaller.
- Med de flesta salter, förutom att bilda hydrater.
- Med silaner och boraner.
- Med kol nokisyu och keten.
- Med fluorider av ädelgaser.
Vid uppvärmning, reagerar med magnesium, järn:
Med metan och kol:
I närvaro av katalysatorer reagerar den:
- Med etrar och amider.
- Med alkyner.
- Med nitriler.
- Med alkener.
Jag hoppas att vår artikel har hjälpt dig att förstå vad ämnet är vatten, och nu kommer du veta mer om det.