Vad är oxider?
Om du inte är förtjust i kemi i skolan är du osannolikmed en körning, kom ihåg vilka oxider som är och vad deras roll i miljön är. Det är faktiskt en ganska vanlig typ av förening, som oftast finns i miljön i form av vatten, rost, koldioxid och sand. Också till oxiderna är mineraler - en slags stenar som har en kristallin struktur.
definition
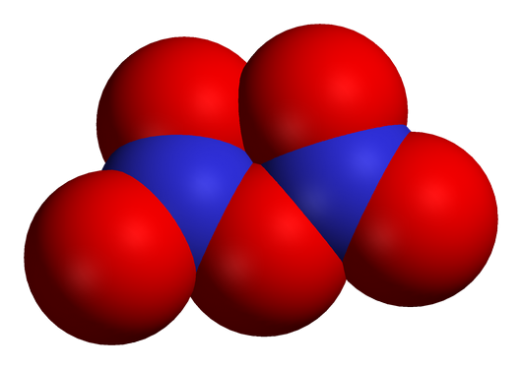
Oxider är kemiska föreningar, i formelnsom innehåller minst en syreatom och atomer av andra kemiska element. Metalloxider innehåller som regel anjon av syre i oxidationstillstånd -2. En betydande del av jordskorpan består av fasta oxider som härstammar under oxidationen av element med syre från luft eller vatten. Vid förbränning av kolväte bildas två huvudsakliga koloxider: kolmonoxid (kolmonoxid, CO) och koldioxid (koldioxid, CO2).
Klassificering av oxider
Alla oxider är uppdelade i två stora grupper:
- saltbildande oxider;
- icke-saltbildande oxider.
Saltbildande oxider är kemikalier där, förutom syre, det finns element i metaller och icke-metaller som bildar syror vid kontakt med vatten och i kombination med baser, salter.
Saltbildande oxider är vidare indelade i:
- basiska oxider, i vilka det andra elementet (1, 2 och ibland 3 valensmetall) under oxidation blir en katjon (Li2O, Na2O, K2O, CuO, Ag2O, MgO, CaO, SrO, BaO, HgO, MnO, CrO, NiO, Fr2O, Cs2O, Rb2O, FeO);
- syraoxider, i vilka, under saltbildning, det andra elementet är fäst vid en negativt laddad syreatom (CO2, SO2, SO3, SiO2, S2O5, CrO3, Mn2O7, Nr2, Cl2O5, Cl2O3);
- amfotera oxider, i vilka det andra elementet (3 och4-valensmetaller eller undantag såsom zinkoxid, berylliumoxid, tennoxid och blyoxid) kan bli både en katjon och förenas med anjonen (ZnO, Cr2O3, Al2O3, SnO, SnO2, PbO, PbO2, TiO2, MnO2, Fe2O3, BeO).
Icke-bildande oxider uppvisar inga sura, basiska eller amfotära egenskaper och, som namnet antyder, bildar de inte salter (CO, NO, NO2, (FeFe2) O4).
Egenskaper hos oxider
- Syreatomer i oxider har en högkemisk aktivitet. På grund av det faktum att syreatomen alltid är negativt laddad bildar den stabila kemiska bindningar med praktiskt taget alla element, vilket orsakar ett stort antal oxider.
- Ädelmetaller, såsom guld och platina,värderas eftersom de inte oxideras naturligt. Korrosion av metaller bildas som ett resultat av hydrolys eller oxidation genom syre. Kombinationen av vatten och syre accelererar endast reaktionshastigheten.
- I närvaro av vatten och syre (eller helt enkelt luft) sker oxidationsreaktionen av vissa element, till exempel natrium, snabbt och kan vara farligt för människor.
- Oxider skapar en skyddande oxidfilmyta. Som ett exempel, aluminiumfolie, som på grund av beläggningen av en tunn film av aluminiumoxid genomgår korrosion mycket långsammare.
- Oxider av de flesta metaller har en polymer struktur, så att de inte bryts ner under lösningen av lösningsmedel.
- Oxider upplöses under verkan av syror ochgrunder. Oxider, som kan reagera med både syror och baser, kallas amfotera. Metaller utgör i regel de grundläggande oxiderna, icke-metaller är syraoxider, och amfotera oxider erhålles från alkalimetaller (metalloider).
- Mängden metalloxid kan reduceras mednågra organiska föreningar. Sådana oxidationsreduceringsreaktioner ligger till grund för många viktiga kemiska omvandlingar, såsom avgiftning av läkemedel som påverkas av P450-enzymer och produktion av etylenoxid, från vilken frostskydd därefter produceras.
De som är kära i kemi kommer också att vara intresserade av följande artiklar:
- Vad är syreinnehållet?
- Hur man får svavel
- Hur man får svavelsyra